台湾 パテントリンケージ制度の紹介(2019年8月実施)
Vol.63(2020年1月13日)
台湾では2019年8月に改正薬事法が施行され、パテントリンケージ制度が実施されている。数年前から米国の制度を基に検討が開始されており、2019年8月に正式にパテントリンケージ制度の運用が開始された。以下にその詳細を紹介する。
概要をまとめると以下の図の通りとなる。
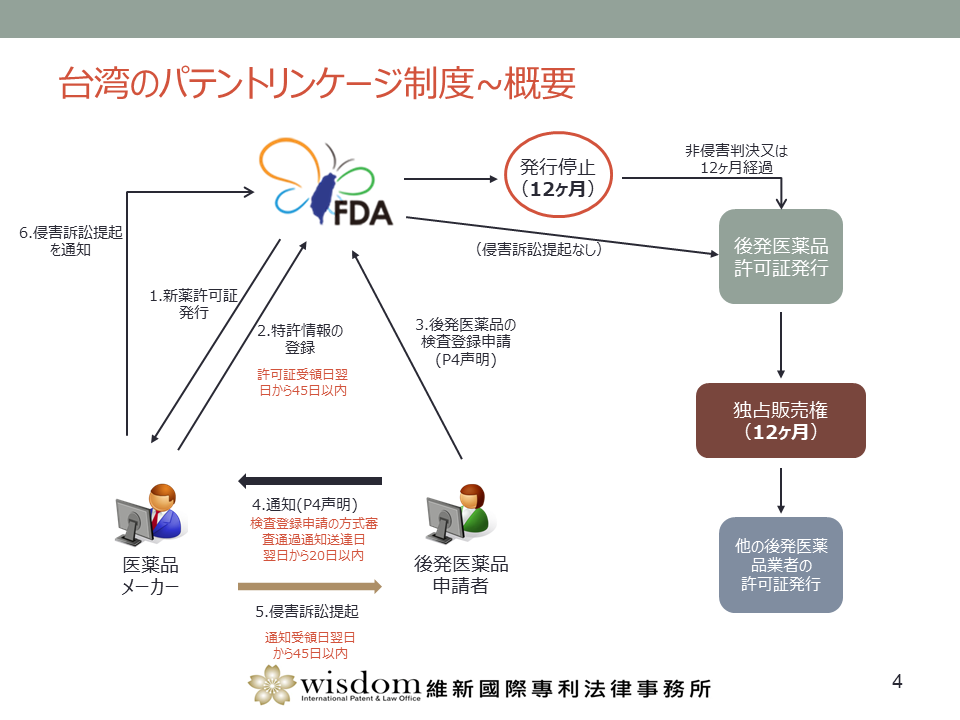
特許情報の登録
新薬メーカーは新薬許可証の取得後45日以内に、所定の手続きに従って特許情報を登録しなければならない。
P4声明
後発医薬品申請者は後発医薬品の検査登録申請時に当該後発医薬品が特許権侵害の疑いがないことを声明(例:P4声明)したうえで、新薬メーカーにも通知をしなければならない。
後発医薬品の検査登録許可証の一時発行停止(12ヶ月)
通対を受けた特許権者は訴訟を提起することができ、訴訟を提起した場合は主務機関に通知をしなければならない。この場合、後発医薬品の検査登録許可証は一時的に発行停止される(12ヶ月)。
独占販売権(12ヶ月)
1件目の後発医薬品検査登録を行った申請者は、当該後発医薬品について12ヶ月の独占独占期間を取得する。
特許情報の登録
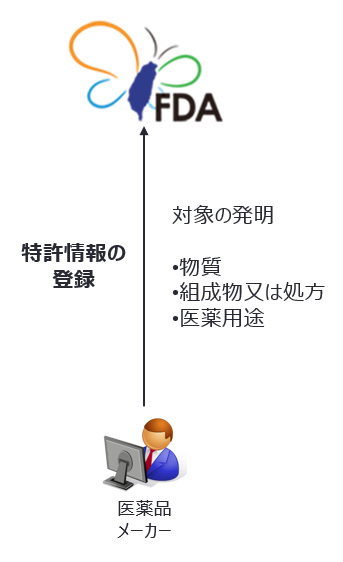 |
新薬許可証の所有者は主務機関(以下、台湾FDA)に対し、指定期間内に特許情報を提出しなければならない。 |
台湾FDAは特許情報登録システム(https://plls.fda.gov.tw/)を運営しており、新薬許可証の所有者は指定期間内に対象となる発明に係る特許権の情報をこのシステムに登録しなければならない。指定期間は、許可証受領日翌日から45日以内である(許可証受領時に特許権が未登録の場合は、特許権公告日から45日以内)。期間内に登録しない場合、パテントリンケージの適用を受けることができない。なお新薬許可証の所有者と特許権者が異なる場合は、特許権者の同意が必要である。ただし、登録された専用実施権がいる場合は、当該専用実施権者の同意があればよい。
特許情報登録の対象となる発明は物質(有効成分等、polymorphismやcrystalline又はamorphousなどの異なる化合物形態も含む)、組成物又は処方、医薬用途(対応する薬品許可証に記載の適応症の一部又は全て)の3つに限られ、製造方法の発明は含まない。
提出すべき情報は以下の通りである。
- 特許証書番号(医薬用途の場合は請求項番号も必要)
- 存続期間満了日
- 特許権者の氏名又は名称、国籍、住居所又は営業所、代表者氏名(代表者がいる場合)、代理人情報(台湾に住所がない場合)
- 登録された専用実施権者がいる場合は、専用実施権者の上記情報
参考:薬事法第48条の3、第48条の4、第48条の5、西薬専利連結施行弁法第3条、第4条、第5条
特許情報の更新
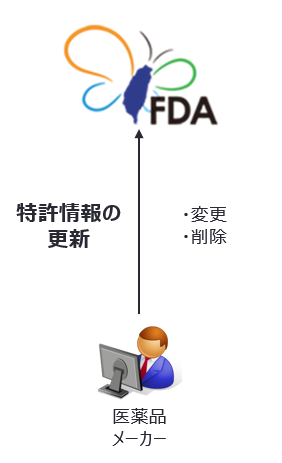 |
新薬許可証の所有者は次に掲げる場合、指定期間内に特許情報の変更又は削除を行わなければならない。 |
指定期間は、以下に示す事情が発生した日の翌日から45日以内である。
- 存続期間の延長登録が公告
- 特許請求の範囲の訂正が公告
- 特許権の無効が確定
- 特許権が消滅
- 特許権者や専用実施権者の氏名又は名称、国籍、住居所又は営業所、代表者氏名、代理人情報に変更があった
参考:薬事法第48条の6
特許情報公開、第三者からの通知
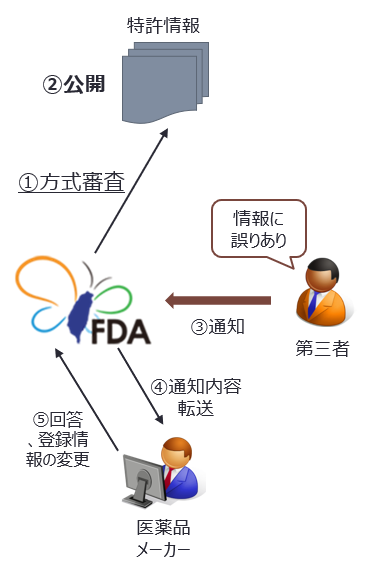 |
主務機関は提出された特許情報、第三者からの通知及び新薬許可証所有者の回答を公開しなければならない。 特許情報に誤りがある等の場合、何人も書面により証拠を付して主務機関に対し通知することができる。 |
上述したように、新薬許可証の所有者には特許登録情報への登録、変更及び削除の義務が課せられているが、台湾FDAは新薬許可証所有者からの登録、変更申請について実質内容の審査は行わない。よって理論上、製造方法の特許権について登録情報の申請が行われ、そのまま登録となる状況が発生し得る(事実と沿わない登録特許情報がされていたとしても、薬事法規定によれば後発医薬品申請者は後述するP1~P4のいずれかの声明をしなければならない。よって極端な場合、事実と沿わない登録特許情報によって後発医薬品メーカーが訴訟に巻き込まれる事態も想定される)。このような事実や条件と合わない登録情報を訂正するための措置として、第三者からの通知という規定が設けられている。
第三者が登録情報の内容が事実と符合していないと認定する場合、台湾FDAに対しその旨を通知することができる。具体的に、以下の状況の場合、何人も台湾FDAに対し通知をすることができる。
- 特許情報に登録された発明が、許可された薬品と関連がない
- 特許情報に登録された発明が、物質、組成物又は処方、医薬用途ではない
- 登録された特許情報に誤りがある
- 特許情報の内容に変動があったが、特許情報の変更又は削除がされていない
通知を受けた台湾FDAは第三者からの通知を受領日翌日後20日以内に、新薬許可証所有者にその通知を転送する。その後、新薬許可証所有者は通知の受領日翌日から45日以内に、書面により回答しなければならない。この際に、特許情報の変更又は削除をすることができる。
こうした規定内容からわかるように、特許情報の登録や更新は新薬許可証所有者の自主性及び第三者からの訂正通知に依頼しており、登録情報の正確性や条件合致性がどこまで担保されるかについては不明である。薬事法第92条の1では、新薬許可証所有者が第三者からの通知の受領日翌日から45日以内に回答しなかった場合、3万元以上50万元以下の罰金に処すると規定されており、さらに薬事法第100条の1では、詐欺又は虚偽不実の方法で特許情報を登録・変更した場合の刑事罰も規定されている。しかしこうした罰金や刑事罰の規定が存在するとしても、新薬許可証所有者に対する強制性はないことから、登録情報の正確性が100%保証されるとは限らない点が問題視されている。
参考:薬事法第48条の7、第48条の8
後発医薬品申請者による声明
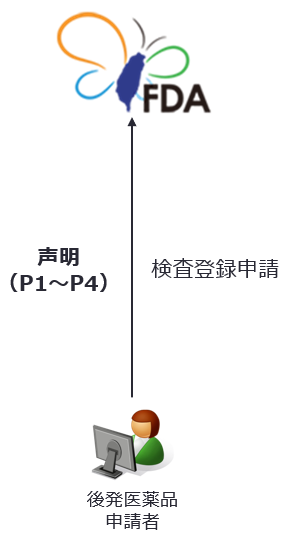 |
後発医薬品の検査登録申請者は、検査登録申請時に、主務機関に対し、新薬許可証に掲載された特許権について、以下の事項のうちの一つを声明しなければならない。 |
後発医薬品の検査登録申請者は検査登録申請時に、新薬許可証に掲載された特許権について、以下の事項のうちの一つを声明しなければならない。
- 当該新薬は特許情報に掲載されていない
- 当該新薬に対応する特許権は既に消滅している
- 当該新薬に対応する特許権が消滅後に、台湾FDAが許可証を発行する
- 当該新薬に対応する特許権は無効となるべき、又は申請に係る後発医薬品は当該新薬に対応する特許権を侵害しない(P4声明)
上記P1又はP2声明がされた場合は、台湾FDAは後発医薬品申請者に対し新薬許可証を発行する。上記P3声明がされた場合は、新薬に対応する特許権の消滅後に、台湾FDAは後発医薬品申請者に対し新薬許可証を発行する。
参考:薬事法第48条の9、第48条の10、第48条の11
P4声明後の後発医薬品メーカーによる通知
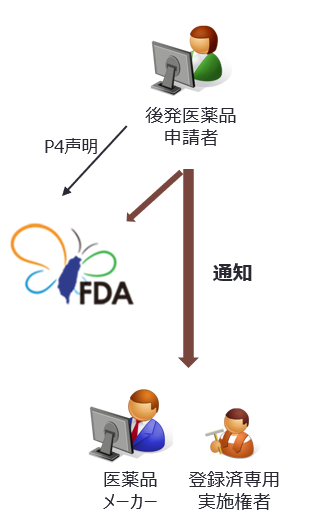 |
P4声明を行った後発医薬品の検査登録申請者は、指定期間内に、新薬許可証所有者に対し書面により通知し、かつ主務機関にも通知しなければならない。 |
後発医薬品申請者からP4声明がされた場合、台湾FDAは検査登録申請の書類の方式審査を進め、問題がなければ後発医薬品申請者に対し資料完備通知を発行する。後発医薬品申請者は資料完備通知送達日翌日から20日以内に新薬許可証所有者に対し書面により通知し、かつ主務機関にも通知しなければならない。新薬許可証所有者と、特許権者及び専用実施権者が異なる場合は、特許権者及び専用実施権者に対しても通知しなければならない。
書面による通知において、当該新薬に対応する特許権が無効となるべき又は権利を侵害しないことについて、理由及び証拠を付さなければならない。後発医薬品検査登録申請者が通知を行わなかった又は行った通知が規定を満たさない場合、台湾FDAは後発医薬品検査登録申請を却下しなければならない。
参考:薬事法第48条の12
訴訟提起及び許可証発行停止
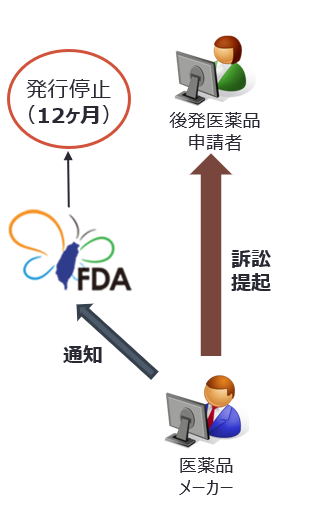 |
特許権者又は専用実施権者は、後発医薬品申請者からの通知受領後、訴訟を提起することができる。訴訟を提起した場合は主務機関に通知する。通知を受けた台湾FDAは後発医薬品の検査登録許可証の発行を12ヶ月時停止する。 |
後発医薬品申請者からP4声明がされ、後発医薬品申請者からの通知を受け取った特許権者(専用実施権者)は、45日間の期間が与えられ後発医薬品申請者に対し侵害訴訟を提起するか検討することができる。訴訟を提起した場合は、訴訟提起日の翌日から20日以内に起訴状コピーを付して台湾FDAに対しその旨を通知しなければならず、通知を受けた台湾FDAは通知受領後12ヶ月は許可証の発行を中止する。
特許権者によるこの訴訟に関し、特許権者が不当に専利権を行使した結果、後発医薬品申請者が許可証発行一時停止により損害を被った時は、特許権者は損害賠償責任を負う。
台湾FDAは12か月の発行停止期間中であっても、検査登録の審査を進める。審査が完了した場合は、後発医薬品申請者に対し審査完了通知を発行し、この際後発医薬品申請者は中央健康保険署に対し、健康保険薬価申請をすることができる。ただし、当然ながら許可証発行前に製造又は輸入をしてはならない。
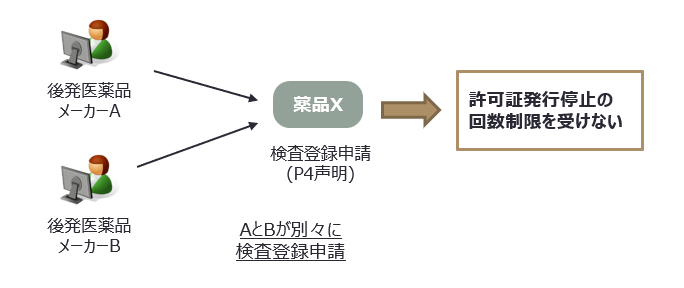
同一の後発医薬品検査登録申請者による同一の後発医薬品検査登録に係る許可証発行停止は、一度に限るとされている。よって同一の後発医薬品検査登録であっても、異なる後発医薬品申請者から検査登録申請がされた場合のP4声明を通じた許可証発行一時停止は、それぞれに対して適用される。
参考:薬事法第48条の13、第48条の14、第48条の15、西薬専利連結施行弁法第12条
許可証発行(発行停止の解除)
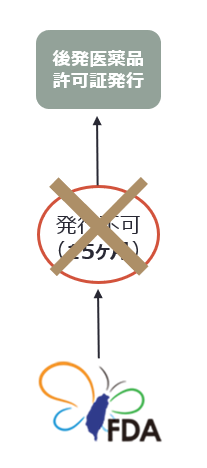 |
次に掲げる場合、台湾FDAは許可証発行一時停止の制限を受けず、審査通過及び本法その他の規定を満たすことを条件として、許可証を発行する。 |
以下に掲げる事情がある場合、許可証発行一時停止が解除され、後発医薬品申請者に対し許可証が発行される。
- 特許権者又は専用実施権者が指定期間内に訴訟を提起しなかった
- 特許権者又は専用実施権者が、後発医薬品検査登録の申請日前に特許情報へ登録された特許権に基づき訴訟を提起しなかった
- 特許権者又は専用実施権者が提起した訴訟において、民事訴訟法第249条第1項又は第2項の規定により、原告の訴えが却下された
- 訴訟提起後、侵害成立の判決が確定せず12ヶ月の期間が経過した(訴訟提起後12ヶ月の期間内に侵害成立の判決が確定した場合は、発行しない)
- 裁判所に係属しているすべての侵害訴訟における特許権について無効原因があると裁判所が認定した、又は侵害を構成しないという判決を後発医薬品申請者が取得した
- P4声明に係る全ての特許権について、台湾特許庁より無効審決が下された
- 当事者間で和解又は調停が成立した(和解協議、仲裁契約は締結日から20日以内に台湾FDAへ通知しなければならず、リバース・ペイメントに関わる場合は、公平交易委員会へも通知しなければならない。)
- P4声明に係る全ての特許権が消滅した
なお、訴訟提起後12ヶ月の期間内に侵害成立の判決が確定した場合は、特許権の存続期間が満了するまで許可証は発行されない。台湾の知的財産裁判所の一審の平均審理期間はおよそ8~9ヶ月であることから、一審で特許権者勝訴の判決が下されてから被告(後発医薬品申請者)が控訴しなかった場合を除き、この12ヶ月の期間内に判決が確定することはほとんど考えられないと思われる。
参考:薬事法第48条の13、薬事法第48条の20
12ヶ月の独占販売権
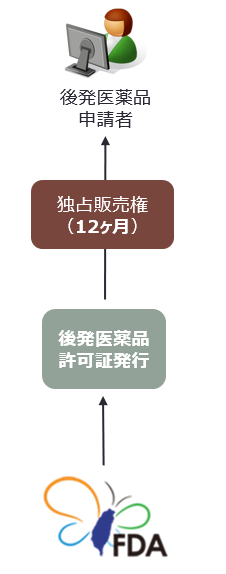 |
P4声明を行った後発医薬品検査登録申請のうち、申請資料が全て揃った日が最も早いものは、当該後発医薬品について12ヶ月の販売専属期間を取得する。 |
P4声明を行った後発医薬品検査登録申請のうち、申請資料が全て揃った日が最も早いものは、当該後発医薬品について12ヶ月の販売専属期間を取得する。台湾FDAは12ヶ月の期間が満了するまで、後発医薬品の他の許可証を発行してはならない。つまり、新薬許可証所有者と後発医薬品申請者の2社によって、独占販売がされることになる。
独占販売期間は、後発医薬品を実際に販売した日を起算日とする(許可証を取得した日ではない)。資料完備日が同日の申請が複数ある場合は、共同で独占販売権を取得する(この場合の独占販売期間起算日は、いずれかの後発医薬品が最初に実際に販売された日となる)。
後発医薬品申請者は許可証の取得日の翌日から6ヶ月以内に当該薬品を販売し、最初の販売日の翌日から20日以内に実際の販売時期の証明文書を提出しなければならない。
以下の場合、独占販売期間は資料完備日が次の申請へ繰り下がって付与される。
- 検査登録審査期間中に、全てのP4声明が変更された
- 資料完備日翌日から12ヶ月以内に、検査登録審査手続きの完了通知を取得しなかった
- 許可証発行停止期間中に、侵害成立の判決が確定した
参考:薬事法第48条の16、薬事法第48条の17
Carve out(Section Viii statement)
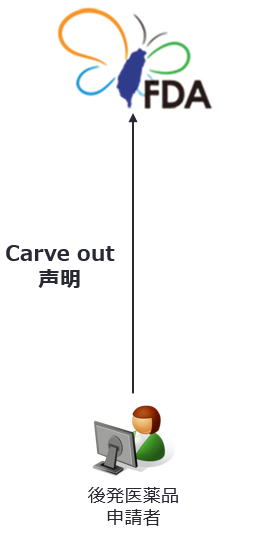 |
以下の要件を満たす後発医薬品申請については、許可証発行一時停止及び独占販売期間に関する規定を適用しない。 |
以下の2つの要件のいずれをも満たす場合は、許可証発行一時停止及び独占販売期間に関する規定は適用されない。これら後発医薬品申請については、新薬の特許権侵害が想定されないため、台湾FDAは審査の完了後に後発医薬品の許可証を発行する。
- 対応する新薬の特許権で存続しているものが、医薬用途の発明のみである
- 後発医薬品申請者が医薬用途発明に係る特許権に対応する適応症を排除し、かつ後発医薬品は当該特許権を侵害しないと声明した
本規定は米国Hatch-Waxman ActのSection viii Statementを参考にして導入された。
参考:薬事法第48条の20
バイオシミラー
当初の薬事法改正草案においては、バイオシミラーをパテントリンケージの対象とするのか、あるいは米国のパテントダンスのように別個の制度を設けるのか、明文規定がされていなかった。しかし現在施行されている西薬専利連結施行弁法において、バイオシミラーについては薬事法のパテントリンケージ制度を準用すると明文規定されている。よって台湾においては韓国やシンガポールと同様に、バイオシミラーもパテントリンケージが適用される(薬事法改正法が施行される前に台湾FDAから臨床試験の承認がされたものを除く)。
また西薬専利連結施行弁法ではバイオシミラーとは、「生物を源として製造され、台湾FDAが製造又は輸入を承認した対応する生物新薬と類似する調剤」と定義されている。
参考:西薬専利連結施行弁法第16条
PDF版は添付ファイルをご参照ください。ご不明な点や質問がありましたら、お気軽にお問い合わせください。弊所でも今後の動向に引き続き注意し、制度変更や重要なニュースがあり次第、逐次報告する予定です。






